Наиболее распространено знание о трех агрегатных состояниях: жидком, твердом, газообразном, иногда вспоминают о плазменном, реже жидкокристаллическом. Последнее время в интернете распространился перечень 17 фаз вещества, взятый из известной () Стивена Фрая. Поэтому мы расскажем о них подробнее, т.к. о материи следует знать немного больше хотя бы для того, чтобы лучше понимать процессы, происходящие во Вселенной.
Приведённый ниже список агрегатных состояний вещества возрастает от самых холодных состояний к самым горячим и т.о. может быть продолжен. Одновременно следует понимать, что от газообразного состояния (№11), самого «разжатого», в обе стороны списка степень сжатия вещества и его давление (с некоторыми оговорками для таких неизученных гипотетических состояний, как квантовое, лучевое или слабо симметричное) возрастают.После текста приведен наглядный график фазовых переходов материи.
1. Квантовое — агрегатное состояние вещества, достигаемое при понижении температуры до абсолютного нуля, в результате чего исчезают внутренние связи и материя рассыпается на свободные кварки.
2. Конденсат Бозе-Эйнштейна
— агрегатное состояние материи, основу которой составляют бозоны, охлаждённые до температур, близких к абсолютному нулю (меньше миллионной доли градуса выше абсолютного нуля). В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе-Эйнштейна (который зачастую называют «бозе-конденсат», или попросту «бэк») возникает, когда вы охлаждаете тот или иной химический элемент до чрезвычайно низких температур (как правило, до температуры чуть выше абсолютного нуля, минус 273 градуса по Цельсию, — теоретическая температура, при которой все перестает двигаться).
Вот тут с веществом начинают происходить совершенно странные вещи. Процессы, обычно наблюдаемые лишь на уровне атомов, теперь протекают в масштабах, достаточно крупных для наблюдения невооруженным глазом. Например, если поместить «бэк» в лабораторный стакан и обеспечить нужный температурный режим, вещество начнет ползти вверх по стенке и в конце концов само по себе выберется наружу.
Судя по всему, здесь мы имеем дело с тщетной попыткой вещества понизить собственную энергию (которая и без того находится на самом низком из всех возможных уровней).
Замедление атомов с использованием охлаждающей аппаратуры позволяет получить сингулярное квантовое состояние, известное как конденсат Бозе, или Бозе — Эйнштейна. Это явление было предсказано в 1925 году А. Эйнштейном, как результат обобщения работы Ш. Бозе, где строилась статистическая механика для частиц, начиная от безмассовых фотоно до обладающих массой атомов (рукопись Эйнштейна, считавшаяся утерянной, была обнаружена в библиотеке Лейденского университета в 2005 году). Результатом усилий Бозе и Эйнштейна стала концепция Бозе газа, подчиняющегося статистике Бозе — Эйнштейна, которая описывает статистическое распределение тождественных частиц с целым спином, называемых бозонами. Бозоны, которыми являются, например, и отдельные элементарные частицы — фотоны, и целые атомы, могут находиться друг с другом в одинаковых квантовых состояниях. Эйнштейн предположил, что охлаждение атомов — бозонов до очень низких температур заставит их перейти (или, по-другому, сконденсироваться) в наинизшее возможное квантовое состояние. Результатом такой конденсации станет возникновение новой формы вещества.
Этот переход возникает ниже критической температуры, которая для однородного трёхмерного газа, состоящего из невзаимодействующих частиц без каких-либо внутренних степеней свободы.
3. Фермионный конденсат
— агрегатное состояние вещества, схожее с бэком, но отличающееся по строению. При приближении к абсолютному нулю атомы ведут себя по-разному в зависимости от величины собственного момента количества движения (спина). У бозонов спины имеют целочисленные значения, а у фермионов - кратные 1/2 (1/2, 3/2, 5/2). Фермионы подчиняются принципу запрета Паули, согласно которому два фермиона не могут иметь одно и то же квантовое состояние. Для бозонов такого запрета нет, и поэтому у них есть возможность существовать в одном квантовом состоянии и образовывать тем самым так называмый конденсат Бозе-Эйнштейна. Процесс образования этого конденсата отвечает за переход в сверхпроводящее состояние.
Электроны имеют спин 1/2 и, следовательно, относятся к фермионам. Они объединяются в пары (так называемые пары Купера), которые затем образуют Бозе-конденсат.
Американские ученые предприняли попытку получить своего рода молекулы из атомов-фермионов при глубоком охлаждении. Отличие от настоящих молекул заключалось в том, что между атомами не было химической связи - просто они двигались вместе, коррелированным образом. Связь между атомами оказалась даже прочнее, чем между электронами в куперовских парах. У образованных пар фермионов суммарный спин уже не кратен 1/2, следовательно, они уже ведут себя как бозоны и могут образовывать бозе-конденсат с единым квантовым состоянием. В ходе эксперимента охлаждали газ из атомов калия-40 до 300 нанокельвинов, при этом газ заключался в так называемую оптическую ловушку. Затем наложили внешнее магнитное поле, с помощью которого удалось изменить природу взаимодействий между атомами - вместо сильного отталкивания стало наблюдаться сильное притяжение. При анализе влияния магнитного поля удалось найти такое его значение, при котором атомы стали вести себя, как куперовские пары электронов. На следующем этапе эксперимента ученые предполагают получить эффекты сверхпроводимости для фермионного конденсата.
4. Сверхтекучее вещество
— состояние, при котором у вещества фактически отсутствует вязкость, а при течении он не испытывает трения с твёрдой поверхностью. Следствием этого является, например, такой интересный эффект, как полное самопроизвольное «выползание» сверхтекучего гелия из сосуда по его стенкам против силы тяжести. Нарушения закона сохранения энергии здесь, конечно же, нет. В отсутствие сил трения на гелий действуют только силы тяжести, силы межатомного взаимодействия между гелием и стенками сосуда и между атомами гелия. Так вот, силы межатомного взаимодействия превышают все остальные силы вместе взятые. В результате гелий стремится растечься как можно сильнее по всем возможным поверхностям, поэтому и «путешествует» по стенкам сосуда. В 1938 году советский учёный Пётр Капица доказал, что гелий может существовать в сверхтекучем состоянии.
Стоит отметить, что многие из необычных свойств гелия известны уже довольно давно. Однако и в последние годы этот химический элемент «балует» нас интересными и неожиданными эффектами. Так, в 2004 году Мозес Чань и Эун-Сьонг Ким из Университета Пенсильвании заинтриговали научный мир заявлением о том, что им удалось получить совершенно новое состояние гелия — сверхтекучее твёрдое вещество. В этом состоянии одни атомы гелия в кристаллической решётке могут обтекать другие, и гелий таким образом может течь сам через себя. Эффект «сверхтвёрдости» теоретически был предсказан ещё в 1969 году. И вот в 2004 году — как будто бы и экспериментальное подтверждение. Однако более поздние и весьма любопытные эксперименты показали, что не всё так просто, и, возможно, такая интерпретация явления, которое до этого принималось за сверхтекучесть твёрдого гелия, неверна.
Эксперимент учёных под руководством Хэмфри Мариса из Университета Брауна в США был прост и изящен. Учёные помещали перевёрнутую вверх дном пробирку в замкнутый резервуар с жидким гелием. Часть гелия в пробирке и в резервуаре они замораживали таким образом, чтобы граница между жидким и твёрдым внутри пробирки была выше, чем в резервуаре. Иными словами, в верхней части пробирки был жидкий гелий, в нижней — твёрдый, он плавно переходил в твёрдую фазу резервуара, над которой был налито немного жидкого гелия — ниже, чем уровень жидкости в пробирке. Если бы жидкий гелий стал просачиваться через твёрдый, то разница уровней уменьшилась бы, и тогда можно говорить о твёрдом сверхтекучем гелии. И в принципе, в трёх из 13 экспериментов разница уровней действительно уменьшалась.
5. Сверхтвёрдое вещество — агрегатное состояние при котором материя прозрачна и может "течь", как жидкость, но фактически она лишена вязкости. Такие жидкости известны много лет, их называют суперфлюидами. Дело в том, что если супержидкость размешать, она будет циркулировать чуть ли не вечно, тогда как нормальная жидкость в конечном счёте успокоится. Первые два суперфлюида были созданы исследователями с использованием гелия-4 и гелия-3. Они были охлаждены почти до абсолютного нуля — до минус 273 градусов Цельсия. А из гелия-4 американским учёным удалось получить сверхтвёрдое тело. Замороженный гелий они сжали давлением более чем в 60 раз, а затем заполненный веществом стакан установили на вращающийся диск. При температуре 0,175 градусов Цельсия диск внезапно начал вращаться свободнее, что, по мнению учёных, свидетельствует о том, что гелий стал супертелом.
6. Твёрдое — агрегатное состояние вещества, отличающееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания вокруг положений равновесия. Устойчивым состоянием твердых тел является кристаллическое. Различают твердые тела с ионной, ковалентной, металлической и др. типами связи между атомами, что обусловливает разнообразие их физических свойств. Электрические и некоторые др. свойства твердых тел в основном определяются характером движения внешних электронов его атомов. По электрическим свойствам твердые тела делятся на диэлектрики, полупроводники и металлы, по магнитным — на диамагнетики, парамагнетики и тела с упорядоченной магнитной структурой. Исследования свойств твердых тел объединились в большую область — физику твердого тела, развитие которой стимулируется потребностями техники.
7. Аморфное твёрдое — конденсированное агрегатное состояние вещества, характеризующееся изотропией физических свойств, обусловленной неупорядоченным расположением атомов и молекул. В аморфных твердых телах атомы колеблются около хаотически расположенных точек. В отличие от кристаллического состояния переход из твердого аморфного в жидкое происходит постепенно. В аморфном состоянии находятся различные вещества: стекла, смолы, пластмассы и т. д.
8. Жидкокристаллическое
— это специфическое агрегатное со-стояние вещества, в котором оно проявляет одновре-менно свойства кристалла и жидкости. Сразу надо огово-риться, что далеко не все вещества могут находиться в жидкокристаллическом состоянии. Однако, некоторые органические вещества, обладающие сложными молеку-лами, могут образовы-вать специфическое агрегатное состояние — жидкокристалли-ческое. Это состояние осуществляется при плавлении кристаллов некоторых веществ. При их плавлении обра-зуется жидкокристаллическая фаза, отличающаяся от обычных жидкостей. Эта фаза существует в интервале от температуры плавления кристалла до некоторой более высокой температуры, при нагреве до которой жидкий кристалл переходит в обычную жидкость.
Чем же жидкий кристалл отличается от жидкости и обычного кристалла и чем похож на них? Подобно обычной жидкости, жидкий кристалл обладает текучестью и принимает форму сосуда, в который он помещен. Этим он отличается от известных всем кристаллов. Однако, несмотря на это свойство, объединяющее его с жид-костью, он обладает свойством, характерным для кри-сталлов. Это - упорядочение в пространстве молекул, образующих кристалл. Правда, это упорядочение не та-кое полное, как в обычных кристаллах, но, тем не менее, оно существенно влияет на свойства жидких кристаллов, чем и отличает их от обычных жидкостей. Неполное про-странственное упорядочение молекул, образующих жид-кий кристалл, проявляется в том, что в жидких кристал-лах нет полного порядка в пространственном располо-жении центров тяжести молекул, хотя частичный порядок может быть. Это означает, что у них нет жесткой кри-сталлической решетки. Поэтому жидкие кристаллы, по-добно обычным жидкостям, обладают свойством текуче-сти.
Обязательным свойством жидких кристаллов, сбли-жающим их с обычными кристаллами, является наличие порядка пространственной ориентации молекул. Такой порядок в ориентации может проявляться, например, в том, что все длинные оси молекул в жидкокристалличе-ском образце ориентированы одинаково. Эти молекулы должны обладать вытянутой формой. Кроме простейше-го названного упорядочения осей молекул, в жидком кристалле может осуществляться более сложный ориентационный порядок молекул.
В зависимости от вида упорядочения осей молекул жидкие кристаллы разделяются на три разновидности: нематические, смектические и холестерические.
Исследования по физике жидких кристаллов и их при-менениям в настоящее время ведутся широким фрон-том во всех наиболее развитых странах мира. Отечествен-ные исследования сосредоточены как в академических, так и отраслевых научно-исследовательских учреждени-ях и имеют давние традиции. Широкую известность и признание получили выполненные еще в тридцатые годы в Ленинграде работы В.К. Фредерикса к В.Н. Цветкова. В последние годы бурного изучения жидких кристаллов отечественные исследователи также вносят весомый вклад в развитие учения о жидких кристаллах в целом и, в частности, об оптике жидких кристаллов. Так, работы И.Г. Чистякова, А.П. Капустина, С.А. Бразовского, С.А. Пикина, Л.М. Блинова и многих других советских иссле-дователей широко известны научной общественности и служат фундаментом ряда эффективных технических приложений жидких кристаллов.
Существование жидких кристаллов было установлено очень давно, а именно в 1888 году, то есть почти столетие назад. Хотя учёные и до 1888 года сталкивались с данным состоянием вещества, но официально его открыли позже.
Первым, кто обнаружил жидкие кристаллы, был авст-рийский ученый-ботаник Рейнитцер. Исследуя новое син-тезированное им вещество холестерилбензоат, он обна-ружил, что при температуре 145°С кристаллы этого ве-щества плавятся, образуя мутную сильно рассеивающую свет жидкость. При продолжении нагрева по достижении температуры 179°С жидкость просветляется, т. е. начина-ет вести себя в оптическом отношении, как обычная жидкость, например вода. Неожиданные свойства холестерилбензоат обнаруживал в мутной фазе. Рассматри-вая эту фазу под поляризационным микроскопом, Рей-нитцер обнаружил, что она обладает двупреломлением. Это означает, что показатель преломления света, т. е скорость света е этой фазе, зависит от поляризации.
9. Жидкое — агрегатное состояние вещества, сочетающее в себе черты твердого состояния (сохранение объема, определенная прочность на разрыв) и газообразного (изменчивость формы). Для жидкости характерны ближний порядок в расположении частиц (молекул, атомов) и малое различие в кинетической энергии теплового движения молекул и их потенциальной энергии взаимодействия. Тепловое движение молекул жидкости состоит из колебаний около положений равновесия и сравнительно редких перескоков из одного равновесного положения в другое, с этим связана текучесть жидкости.
10. Сверхкритический флюид
(СКФ) — агрегатное состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки является сверхкритическим флюидом. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, и низкой вязкостью, как и газы. Коэффициент диффузии при этом имеет промежуточное между жидкостью и газом значение. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определенными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода.
Одно из наиболее важных свойств сверхкритического состояния - это способность к растворению веществ. Изменяя температуру или давление флюида можно менять его свойства в широком диапазоне. Так, можно получить флюид, по свойствам близкий либо к жидкости, либо к газу. Так, растворяющая способность флюида увеличивается с увеличением плотности (при постоянной температуре). Поскольку плотность возрастает при увеличении давления, то меняя давление можно влиять на растворяющую способность флюида (при постоянной температуре). В случае с температурой завистимость свойств флюида несколько более сложная - при постоянной плотности растворяющая способность флюида также возрастает, однако вблизи критической точки незначительное увеличение температуры может привести к резкому падению плотности, и, соответственно, растворяющей способности. Сверхкритические флюиды неограниченно смешиваются друг с другом, поэтому при достижении критической точки смеси система всегда будет однофазной. Приблизительная критическая температура бинарной смеси может быть рассчитана как среднее арифмитическое от критических параметров веществ Tc(mix) = (мольная доля A) x TcA + (мольная доля B) x TcB.
11. Газообразное — (франц. gaz, от греч. chaos — хаос), агрегатное состояние вещества, в котором кинетическая энергия теплового движения его частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию взаимодействий между ними, в связи с чем частицы движутся свободно, равномерно заполняя в отсутствие внешних полей весь предоставленный им объем.
12. Плазма — (от греч. plasma — вылепленное, оформленное), состояние вещества, представляющее из себя ионизованный газ, в котором концентрации положительных и отрицательных зарядов равны (квазинейтральность). В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра, магнитосферы и ионосферы. Высокотемпературная плазма (Т ~ 106 — 108К) из смеси дейтерия и трития исследуется с целью осуществления управляемого термоядерного синтеза. Низкотемпературная плазма (Т Ј 105К) используется в различных газоразрядных приборах (газовых лазерах, ионных приборах, МГД-генераторах, плазмотронах, плазменных двигателях и т. д.), а также в технике (см. Плазменная металлургия, Плазменное бурение, Плазменная технология).
13. Вырожденное вещество — является промежуточной стадией между плазмой и нейтрониумом. Оно наблюдается в белых карликах, играет важную роль в эволюции звезд. Когда атомы находятся в условиях чрезвычайно высоких температур и давлений, они теряют свои электроны (они переходят в электронный газ). Другими словами, они полностью ионизованы (плазма). Давление такого газа (плазмы) определяется давлением электронов. Если плотность очень высока, все частицы вынуждены приближаться к друг другу. Электроны могут находится в состояниях с определенными энергиями, причем два электрона не могут иметь одинаковую энергию (если только их спины не противоположны). Таким образом, в плотном газе все нижние уровни энергии оказываются заполненными электронами. Такой газ называется вырожденным. В этом состоянии электроны проявляют вырожденное электронное давление, которое противодействует силам гравитации.
14. Нейтрониум
— агрегатное состояние, в которое вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
При сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов.
15. Кварк-глюонная плазма
(хромоплазма) — агрегатное состояние вещества в физике высоких энергий и физике элементарных частиц, при котором адронное вещество переходит в состояние, аналогичное состоянию, в котором находятся электроны и ионы в обычной плазме.
Обычно вещество в адронах находится в так называемом бесцветном («белом») состоянии. То есть, кварки различных цветов компенсируют друг друга. Аналогичное состояние есть и у обычного вещества — когда все атомы электрически нейтральны, то есть,
положительные заряды в них компенсированы отрицательными. При высоких температурах может происходить ионизация атомов, при этом заряды разделяются, и вещество становится, как говорят, «квазинейтральным». То есть, нейтральным остаётся всё облако вещества в целом, а отдельные его частицы нейтральными быть перестают. Точно так же, по-видимому, может происходить и с адронным веществом — при очень высоких энергиях, цвет выходит на свободу и делает вещество «квазибесцветным».
Предположительно, вещество Вселенной находилось в состоянии кварк-глюонной плазмы в первые мгновения после Большого Взрыва. Сейчас кварк-глюонная плазма может на короткое время образовываться при соударениях частиц очень высоких энергий.
Кварк-глюонная плазма была получена экспериментально на ускорителе RHIC Брукхейвенской национальной лаборатории в 2005 году. Максимальная температура плазмы в 4 триллиона градусов Цельсия была получена там же в феврале 2010 года.
16. Странное вещество
— агрегатное состояние, при котором материя сжимается до предельных значений плотности, оно может существовать в виде "кваркового супа". Кубический сантиметр вещества в этом состоянии будет весить миллиарды тонн; к тому же он будет превращать любое нормальное вещество, с которым соприкоснётся, в ту же "странную" форму с выбросом значительного количества энергии.
Энергия, которая может выделиться при превращении вещества ядра звезды в "странное вещество", приведёт к сверхмощному взрыву "кварковой новой", - и, по мнению Лихи и Уйеда, именно его астрономы в сентябре 2006 года и наблюдали.
Процесс образования этого вещества начался с обычной сверхновой, в которую обратилась массивная звезда. В результате первого взрыва образовалась нейтронная звезда. Но, по мнению Лихи и Уйеда, просуществовала она очень недолго, - по мере того, как её вращение казалось затормозилось её собственным магнитным полем, она начала сжиматься ещё сильнее, с образованием сгустка "странного вещества", что привело к ещё более мощному, нежели при обычном взрыве сверхновой, выбросу энергии - и внешних слоёв вещества бывшей нейтронной звезды, разлетавшихся в окружающее пространство со скоростью, близкой к скорости света.
17. Сильно симметричное вещество
— это вещество, сжатое до такой степени, при которой микрочастицы внутри него наслаиваются друг на друга, а само тело коллапсирует в чёрную дыру. Термин «симметрия» объясняется следующим: Возьмём известные всем со школьной скамьи агрегатные состояния вещества - твёрдые, жидкие, газообразные. Для определённости в качестве твёрдого вещества рассмотрим идеальный бесконечный кристалл. В нём существует определённая, так называемая дискретная симметрия относительно переноса. Это означает, что, если сдвинуть кристаллическую решётку на расстояние, равное интервалу между двумя атомами, в ней ничего не изменится - кристалл совпадет сам с собой. Если же кристалл расплавить, то симметрия получившейся из него жидкости будет иной: она возрастёт. В кристалле равноценными были только точки, удалённые друг от друга на определённые расстояния, так называемые узлы кристаллической решётки, в которых находились одинаковые атомы.
Жидкость же однородна по всему объёму, все её точки неотличимы одна от другой. Это означает, что жидкости можно смещаться на любые произвольные расстояния (а не только на какие-то дискретные, как в кристалле) или поворачиваться на любые произвольные углы (чего в кристаллах делать нельзя вообще) и она будет совпадать сама с собой. Степень её симметрии выше. Газ ещё более симметричен: жидкость занимает определённый объём в сосуде и наблюдается асимметрия внутри сосуда, где жидкость есть, и точки, где её нет. Газ же занимает весь предоставленный ему объём, и в этом смысле все её точки неотличимы одна от другой. Всё же здесь было бы правильнее говорить не о точках, а о малых, но макроскопических элементах, потому что на микроскопическом уровне отличия всё-таки есть. В одних точках в данный момент времени имеются атомы или молекулы, а в других нет. Симметрия наблюдается только в среднем, либо по некоторым макроскопическим параметра объёма, либо по времени.
Но мгновенной симметрии на микроскопическом уровне здесь по-прежнему ещё нет. Если же вещество сжимать очень сильно, до давлений которые в обиходе недопустимы, сжимать так, что атомы были раздавлены, их оболочки проникли друг в друга, а ядра начали соприкасаться, возникает симметрия и на микроскопическом уровне. Все ядра одинаковы и прижаты друг к другу, нет не только межатомных, но и межъядерных расстояний и вещество становится однородным (странное вещество).
Но есть ещё субмикроскопический уровень. Ядра состоят из протонов и нейтронов, которые двигаются внутри ядра. Между ними тоже есть какое-то пространство. Если продолжать сжимать так, что будут раздавлены и ядра, нуклоны плотно прижмутся друг к другу. Тогда и на субмикроскопическом уровне появится симметрия, которой нет даже внутри обычных ядер.
Из сказанного можно усмотреть вполне определённую тенденцию: чем выше температура и больше давление, тем более симметричным становится вещество. Исходя из этих соображений сжатое до максимума вещество именуется сильно симметричным.
18. Слабо симметричное вещество — состояние, противоположное сильно симметричному веществу по своим свойствам, присутствовавшее в очень ранней Вселенной при температуре близкой к планковской, возможно, через 10-12 секунд после Большого Взрыва, когда сильные, слабые и электромагнитные силы представляли из себя единую суперсилу. В этом состоянии вещество сжато до такой степени, что его масса переходит в энергию, которая начинает инфлуировать, то есть неограниченно расширяться. Достичь энергий для экспериментального получения суперсилы и перевода вещества в эту фазу в земных условиях пока невозможно, хотя такие попытки предпринимались на Большом Адронном Коллайдере с целью изучения ранней вселенной. Ввиду отсутствия в составе суперсилы, образующей это вещество, гравитационного взаимодействия, суперсила является не достаточно симметричной в сравнении с суперсимметричной силой, содержащей все 4 вида взаимодействий. Поэтому данное агрегатное состояние и получило такое название.
19. Лучевое вещество
— это, по сути дела, уже совсем не вещество, а в чистом виде энергия. Однако именно это гипотетическое агрегатное состояние примет тело, достигшее скорости света. Также его можно получить, разогрев тело до планковской температуры (1032К), то есть разогнав молекулы вещества до скорости света. Как следует из теории относительности, при достижении скорости более 0,99 с, масса тела начинает расти гораздо быстрее, нежели при "обычном" ускорении, кроме того тело удлиняется, разогревается, то есть начинает излучать в инфракрасном спектре. При пересечении порога 0,999 с, тело кардинально видоизменяется и начинает стремительный фазовый переход вплоть до лучевого состояния. Как следует из формулы Эйнштейна, взятой в полном виде, растущая масса итогового вещества складывается из масс, отделяющихся от тела в виде теплового, рентгеновского, оптического и других излучений, энергия каждого из которых описывается следующим членом в формуле. Таким образом, тело приблизившееся к скорости света начнет излучать во всех спектрах, расти в длину и замедляться во времени, утоньшаясь до планковской длины, то есть по достижении скорости с, тело превратится в бесконечно длинный и тонкий луч, двигающийся со скоростью света и состоящий из фотонов, не имеющих длины, а его бесконечная масса полностью перейдет в энергию. Поэтому такое вещество и называется лучевым.
Определение
Агрегатные состояния вещества (от латинского aggrego -- присоединяю, связываю) -- это состояния одного и того же вещества твердое, жидкое, газообразное.
При переходе из одного состояния в другое происходит скачкообразное изменение энергии, энтропии, плотности и других характеристик вещества.
Твердые и жидкие тела
Определение
Твердыми телами называются тела, отличающиеся постоянством формы и объема.
В них межмолекулярные расстояния малы и потенциальная энергия молекул сравнима с кинетической. Твёрдые тела делятся на два вида: на кристаллические и аморфные. В состоянии термодинамического равновесия пребывают лишь кристаллические тела. Аморфные же тела по сути представляют метастабильные состояния, которые по своему строению приближаются к неравновесным, медленно кристаллизующимся жидкостям. В аморфном теле идет очень медленный процесс кристаллизации, процесс постепенного перехода вещества в кристаллическую фазу. Отличие кристалла от аморфного твёрдого тела заключается прежде всего в анизотропии его свойств. Свойства кристаллического тела зависят от направления в пространстве. Различного рода процессы, такие как теплопроводность, электропроводность, свет, звук, распространяются в различных направлениях твёрдого тела по-разному. Аморфные же тела (стекло, смолы, пластмассы) изотpопны, как и жидкости. Отличие аморфных тел от жидкостей состоит только в том, что последние текучи, в них невозможны статические деформации сдвига.
Кристаллические тела обладают правильным молекулярным строением. Именно правильному строению кристалла обязана анизотропия его свойств. Правильное расположение атомов кристалла образует так называемую кристаллическую решётку. В различных направлениях расположение атомов в решётке различно, что и ведет к анизотропии. Атомы (или ионы, или целые молекулы) в кристаллической решётке совершают беспорядочное колебательное движение около средних положений, которые и рассматриваются как узлы кристаллической решётки. Чем больше температура, тем больше энергия колебаний, а следовательно, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний находится размер кристалла. Рост амплитуды колебаний ведет к росту размеров тела. Так объясняется тепловое расширение твёрдых тел.
Определение
Жидкими называют тела, которые имеют определенный объем, но не имеют упругости формы.
Жидкости отличаются сильным межмолекулярным взаимодействием и малой сжимаемостью. Жидкость занимает промежуточное положение между твёрдым телом и газом. Жидкости, как и газы, изотpопны. Кроме того, жидкость обладает текучестью. В ней, как и в газах, отсутствуют касательные напряжения (напряжения на сдвиг) тел. Жидкости тяжелы, т.е. их удельные веса сравнимы с удельными весами твёрдых тел. Вблизи температур кристаллизации их теплоемкости и другие тепловые характеристики близки к соответствующим характеристикам твёрдых тел. В жидкостях наблюдается до известной степени правильное расположение атомов, но лишь в малых областях. Здесь атомы тоже совершают колебательное движение возле узлов квазикpисталлической ячейки, но в отличие от атомов твёрдого тела они время от времени перескакивают от одного узла к другому. В результате движение атомов будет весьма сложным: оно колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Определение
Газ -- такое состояние вещества, в котором расстояния между молекулами велики.
Силами взаимодействия между молекулами при невысоких давлениях можно пренебречь. Частицы газа заполняют весь объем, который предоставлен газу. Газы можно рассматривать как сильно перегретые или ненасыщенные пары. Особым видом газа является плазма -- это частично ли полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. Плазма представляет собой газ из заряженных частиц, которые взаимодействуют между собой с помощью электрических сил на большом расстоянии, но не имеют ближнего и дальнего расположения частиц.
Вещества могут переходить из одного агрегатного состояния в другое.
Определение
Испарение -- это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул.
Испарение -- это фазовый переход. При испарении часть жидкости или твердого тела переходит в пар. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью называется насыщенным паром. При этом изменение внутренней энергии тела:
\[\triangle \ U=\pm mr\ \left(1\right),\]
где m -- масса тела, r -- удельная теплота парообразования (Дж/кг).
Определение
Конденсация -- процесс, обратный парообразованию.
Расчет изменения внутренней энергии происходит по формуле (1).
Определение
Плавление -- процесс перехода вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
Когда вещество нагревают увеличивается его внутренняя энергия, следовательно, увеличивается скорость теплового движения молекул. В том случае, если достигнута температура плавления вещества, то кристаллическая решетка твердого тела начинает разрушаться. Связи между частицами разрушаются, возрастает энергия взаимодействия между частицами. Теплота, передаваемая телу, идет на увеличении внутренней энергии этого тела, и часть энергии идет на совершение работы по изменению объема тела при его плавлении. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например, лед, чугун. Аморфные тела не имеют определенной температуры плавления. Плавление является фазовым переходом, который сопровождается скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она не изменяется в ходе процесса. При этом изменение внутренней энергии тела:
\[\triangle U=\pm m\lambda \left(2\right),\]
где $\lambda $ -- удельная теплота плавления (Дж/кг).
Процесс обратный плавлению - кристаллизация. Расчет изменения внутренней энергии происходит по формуле (2).
Изменение внутренней энергии каждого тела системы в случае нагревания или охлаждения можно рассчитать по формуле:
\[\triangle U=mc\triangle T\left(3\right),\]
где c - удельная теплоемкость вещества, Дж/(кгК), $\triangle T$- изменение температуры тела.
При изучении переходов веществ из одних агрегатных состояний в другие невозможно обойтись без так называемого уравнения теплового баланса , которое гласит: суммарное количество теплоты, которое выделяется в теплоизолированной системе, равно количеству теплоты (суммарному), которое в этой системе поглощается.
По своему смыслу, уравнение теплового баланса -- это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
Пример 1
Задание: В теплоизолированном сосуде находятся вода и лед при температуре $t_i= 0^oС$. Масса воды ($m_{v\ })$ и льда ($m_{i\ })$ соответственно равны 0,5 кг и 60 гр. В воду впускается водяной пар массой $m_{p\ }=$10 гр. при температуре $t_p= 100^oС$. Какой станет температура воды в сосуде после установления теплового равновесия? Теплоемкость сосуда не учитывать.
Решение: Определим, какие процессы происходят в системе, какие агрегатные состояния вещества мы имели и какие получили.
Водяной пар конденсируется, отдавая тепло.
Это тепло идет на плавление льда и, возможно, нагрев имеющейся и полученной изо льда воды.
Проверим сначала, какое количество теплоты выделяется при конденсации имеющейся массы пара:
здесь из справочных материалов имеем $r=2,26 10^6\frac{Дж}{кг}$- удельная теплота парообразования (применима и для конденсации).
Для плавления льда необходимо тепла:
здесь из справочных материалов имеем $\lambda =3,3\cdot 10^5\frac{Дж}{кг}$- удельная теплота плавления льда.
Получаем, что пар отдает тепла больше, чем требуется, только для расплавления имеющегося льда, следовательно уравнение теплового баланса запишем в виде:
Теплота выделяется при конденсации пара массой $m_{p\ }$ и остывании воды, которая образуется из пара от температуры $T_p$ до искомой T. Теплота поглощается при плавлении льда массой $m_{i\ }$ и нагревании воды массой $m_v+m_i$ от температуры $T_i$до $T.\ $ Обозначим $T-T_i=\triangle T$, для разности $T_p-T$ получим:
Уравнение теплового баланса приобретет вид:
\ \ \[\triangle T=\frac{rm_{p\ }+cm_{p\ }100-лm_{i\ }}{c\left(m_v+m_i+m_{p\ }\right)}\left(1.6\right)\]
Проведем вычисления, учитывая, что теплоемкость воды табличная $c=4,2\cdot 10^3\frac{Дж}{кгК}$, $T_p=t_p+273=373K,$ $T_i=t_i+273=273K$:
$\triangle T=\frac{2,26\cdot 10^6\cdot 10^{-2}+4,2\cdot 10^3\cdot 10^{-2}10^2-6\cdot 10^{-2}\cdot 3,3\cdot 10^5}{4,2\cdot 10^3\cdot 5,7\cdot 10^{-1}}\approx 3\left(К\right)$тогда T=273+3=276 (K)
Ответ: Температура воды в сосуде после установления теплового равновесия станет равна 276 К.
Пример 2
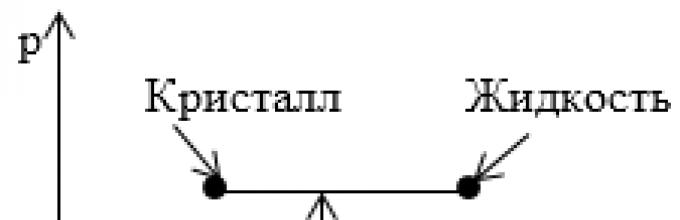
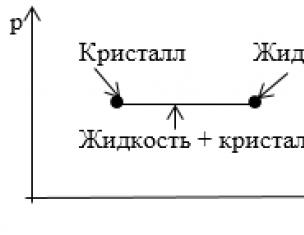
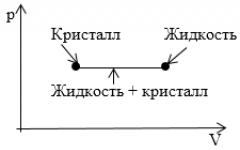
Задание: На рисунке показан участок изотермы, отвечающий переходу вещества из кристаллического в жидкое состояние. Что соответствует этому участку на диаграмме p,T?

Вся совокупность состояний, изображенных на диаграмме p,V горизонтальным отрезком прямой на диаграмме p,T изображается одной точкой, определяющей значения p и T, при которых осуществляется переход из одного агрегатного состояния в другое.
Агрегатное состояние вещества
Вещество – реально существующая совокупность частиц, связанных между собой химическими связями и находящихся при определенных условиях в одном из агрегатных состояний. Любое вещество состоит из совокупности очень большого числа частиц: атомов, молекул, ионов, которые могут объединяться между собой в ассоциаты, называемые также агрегатами или кластерами. В зависимости от температуры и поведения частиц в ассоциатах (взаимное расположение частиц, их число и взаимодействие в ассоциате, а также распределение ассоциатов в пространстве и их взаимодействии между собой) вещество может находиться в двух основных агрегатных состояниях – кристаллическом (твердом) или газообразном, и в переходных агрегатных состояниях – аморфном (твердом), жидкокристаллическом, жидком и парообразном. Твердое, жидкокристаллическое и жидкое агрегатные состояния являются конденсированными, а парообразное и газообразное – сильно разряженными.
Фаза – это совокупность однородных микрообластей, характеризующихся одинаковой упорядоченностью и концентрацией частиц и заключенных в макроскопическом объеме вещества, ограниченном поверхностью раздела. В таком понимании фаза характерна только для веществ, находящихся в кристаллическом и газообразном состояниях, т.к. это однородные агрегатные состояния.
Метафаза – это совокупность разнородных микрообластей, отличающихся друг от друга степенью упорядоченности частиц или их концентрацией и заключенных в макроскопическом объеме вещества, ограниченном поверхностью раздела. В таком понимании метафаза характерна только для веществ, находящихся в неоднородных переходных агрегатных состояний. Разные фазы и метафазы могут смешиваться между друг с другом, образуя одно агрегатное состояние, и тогда между ними нет поверхности раздела.
Обычно не разделяют понятия «основное» и «переходное» агрегатные состояния. Понятия «агрегатное состояние», «фаза» и «мезофаза» часто используют как синонимы. Целесообразно рассматривать для состояния веществ пять возможных агрегатных состояний: твердое, жидкокристаллическое, жидкое, парообразное, газообразное. Переход одной фазы в другую фазу называют фазовым переходом первого и второго рода. Фазовые переходы первого рода характеризуются:
Скачкообразным изменением физических величие, описывающих состояние вещества (объем, плотность, вязкость и т.д.);
Определенной температурой, при которой совершается данный фазовый переход
Определенной теплотой, характеризующий данный переход, т.к. рвутся межмолекулярные связи.
Фазовые переходы первого рода наблюдаются при переходе из одного агрегатного состояния в другое агрегатное состояние. Фазовые переходы второго рода наблюдаются при изменении упорядоченности частиц в пределах одного агрегатного состояния, характеризуются:
Постепенное изменение физических свойств вещества;
Изменение упорядоченности частиц вещества под действием градиента внешних полей или при определенной температуры, называемой температурой фазового перехода;
Теплота фазовых переходов второго рода равна и близка к нулю.
Главное различие фазовых переходов первого и второго рода заключается в том, что при переходах первого рода, прежде всего, изменяется энергия частиц системы, а в случае переходов второго рода – упорядоченность частиц системы.
Переход вещества из твердого состояния в жидкое называется плавлением и характеризуется температурой плавления. Переход вещества из жидкого в парообразное состояние называется испарением и характеризуется температурой кипения. Для некоторых веществ с небольшой молекулярной массой и слабым межмолекулярным взаимодействием возможен непосредственный переход из твердого состояния в парообразное, минуя жидкое. Такой переход называется сублимацией. Все перечисленные процессы могут протекать и в обратном направлении: тогда их называют замерзанием, конденсацией, десублимацией.
Вещества, не разлагающиеся при плавлении и кипении, могут находиться в зависимости от температуры и давления во всех четырех агрегатных состояниях.
Твердое состояние
При достаточно низкой температуре практически все вещества находятся в твердом состоянии. В этом состоянии расстояние между частицами вещества сопоставимы с размерами самих частиц, что обеспечивает их сильное взаимодействие и значительное превышение у них потенциальной энергии над кинетической энергией.. Движение частиц твердого вещества ограничено только незначительными колебаниями и вращениями относительно занимаемого положения, а поступательное движение у них отсутствует. Это приводит к внутренней упорядоченности в расположении частиц. Поэтому для твердых тел характерна собственная форма, механическая прочность, постоянный объем (они практически несжимаемы). В зависимости от степени упорядоченности частиц твердые вещества разделяются на кристаллические и аморфные.
Кристаллические вещества характеризуются наличием порядка в расположении всех частиц. Твердая фаза кристаллических веществ состоит из частиц, которые образуют однородную структуру, характеризующуюся строгой повторяемостью одной и той же элементарной ячейки во всех направлениях. Элементарная ячейка кристалла характеризует трехмерную периодичность в расположении частиц, т.е. его кристаллическую решетку. Кристаллические решетки классифицируются в зависимости от типа частиц, составляющих кристалл, и от природы сил притяжения между ними.

Многие кристаллические вещества в зависимости от условий (температура, давление) могут иметь разную кристаллическую структуру. Это явление называется полиморфизмом. Общеизвестные полиморфные модификации углерода: графит, фуллерен, алмаз, карбин.

Аморфные (бесформенные) вещества. Это состояние характерно для полимеров. Длинные молекулы легко изгибаются и переплетаются с другими молекулами, что приводит к нерегулярности в расположении частиц.
Отличие аморфных частиц от кристаллических:
изотропия – одинаковость физических и химических свойств тела или среды по всем направлениям, т.е. независимость свойств от направления;
отсутствие фиксированной температуры плавления.
Аморфную структуру имеют стекло, плавленый кварц, многие полимеры. Аморфные вещества менее устойчивы, чем кристаллические, и поэтому любое аморфное тело со временем может перейти в энергетически более устойчивое состояние – кристаллическое.
Жидкое состояние
При повышении температуры энергия тепловых колебаний частиц возрастает, и для каждого вещества имеется температура, начиная с которой энергия тепловых колебаний превышает энергию связей. Частицы могут совершать различные движения, смещаясь относительно друг друга. Они еще остаются в контакте, хотя правильная геометрическая структура частиц нарушается – вещество существует в жидком состоянии. Вследствие подвижности частиц для жидкого состояния характерны броуновское движение, диффузия и летучесть частиц. Важным свойством жидкости является вязкость, которая характеризует межассоциатные силы, препятствующие свободному течению жидкости.
Жидкости занимают промежуточное положение между газообразным и твердым состоянием веществ. Более упорядочная структура, чем газ, но менее чем твердое вещество.
Паро – и газообразное состояния
Паро-газообразное состояние обычно не различают.
Газ – это сильно разряженная однородная система, состоящая из отдельных молекул, далеко отстоящих друг от друга, которую можно рассматривать как единую динамическую фазу.
Пар - это сильно разряженная неоднородная система, представляющая собой смесь молекул и неустойчивых небольших ассоциатов, состоящих из этих молекул.
Молекулярно-кинетическая теория объясняет свойства идеального газа, основываясь на следующих положениях: молекулы совершают непрерывное беспорядочное движение; объем молекул газа пренебрежимо мал по сравнению с межмолекулярными расстояниями; между молекулами газа не действуют силы притяжения или отталкивания; средняя кинетическая энергия молекул газа пропорциональна его абсолютной температуре. Вследствие незначительности сил межмолекулярного взаимодействия и наличия большого свободного объема для газов характерны: высокая скорость теплового движения и молекулярной диффузии, стремление молекул занять как можно больший объем, а также большая сжимаемость.
Изолированная газофазная система характеризуется четырьмя параметрами: давлением, температурой, объемом, количеством вещества. Связь между данными параметрами описывается уравнением состояния идеального газа:
R = 8,31 кДж/моль – универсальная газовая постоянная.

Агрегатные состояния. Жидкости. Фазы в термодинамике. Фазовые переходы.
Лекция 1.16
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном . Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. В газообразном состоянии вещество не имеет ни собственного объема, ни собственной формы. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов. При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие.
Твердые (кристаллические) тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение представляет собой колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Свойства жидкостей.
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, так же как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей. Из-за сильного взаимодействия между близко расположенными молекулами они могут образовывать локальные (неустойчивые) упорядоченные группы, содержащие несколько молекул. Это явление называется ближним порядком .
Вследствие плотной упаковки молекул сжимаемость жидкостей, т. е. изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах. Например, для изменения объема воды на 1 % нужно увеличить давление приблизительно в 200 раз. Такое увеличение давления по сравнению с атмосферным достигается на глубине около 2 км.
Жидкости, как и твердые тела, изменяют свой объем при изменении температуры. Для не очень больших интервалов температур относительное изменение объема ΔV / V 0 пропорционально изменению температуры ΔT :
| |
Коэффициент β называют температурным коэффициентом объемногорасширения . Этот коэффициент у жидкостей в десятки раз больше, чем у твердых тел. У воды, например, при температуре 20 °С β в ≈ 2·10 –4 К –1 , у стали - β ст ≈ 3,6·10 –5 К –1 , у кварцевого стекла - β кв ≈ 9·10 –6 К –1 .
Тепловое расширение воды имеет интересную и важную для жизни на Земле аномалию. При температуре ниже 4 °С вода расширяется при понижении температуры (β < 0). Максимум плотности ρ в = 10 3 кг/м 3 вода имеет при температуре 4 °С.
При замерзании вода расширяется, поэтому лед остается плавать на поверхности замерзающего водоема. Температура замерзающей воды подо льдом равна 0 °С. В более плотных слоях воды у дна водоема температура оказывается порядка 4 °С. Благодаря этому, жизнь может существовать в воде замерзающих водоемов.
Наиболее интересной особенностью жидкостей является наличие свободнойповерхности . Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Поверхностные молекулы силами межмолекулярного притяжения втягиваются внутрь жидкости. Но все молекулы, в том числе и молекулы пограничного слоя, должны находиться в состоянии равновесия. Это равновесие достигается за счет некоторого уменьшения расстояния между молекулами поверхностного слоя и их ближайшими соседями внутри жидкости. При уменьшении расстояния между молекулами возникают силы отталкивания. Если среднее расстояние между молекулами внутри жидкости равно r 0 , то молекулы поверхностного слоя упакованы несколько более плотно, а поэтому они обладают дополнительным запасом потенциальной энергии по сравнению с внутренними молекулами. Следует иметь в виду, что вследствие крайне низкой сжимаемости наличие более плотно упакованного поверхностного слоя не приводит к сколь нибудь заметному изменению объема жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (т. е. увеличить площадь поверхности жидкости), внешние силы должны совершить положительную работу A внеш, пропорциональную изменению ΔS площади поверхности:
| A внеш = σΔS . |
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях наметр квадратный (Дж/м 2) или в ньютонах на метр(1 Н/м = 1 Дж/м 2).
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальнойэнергией
. Потенциальная энергия E
р поверхности жидкости пропорциональна ее площади: ![]() (1.16.1)
(1.16.1)
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения .
Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку, с той только разницей, что упругие силы в пленке зависят от площади ее поверхности (т. е. от того, как пленка деформирована), а силы поверхностного натяжения не зависят от площади поверхности жидкости.
Силы поверхностного натяжения стремятся сократить поверхность пленки. Поэтому можно записать: (1.16.2)
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей наединицу длины линии, ограничивающей поверхность (l - длина этой линии).
Из-за действия сил поверхностного натяжения в каплях жидкости и внутри мыльных пузырей возникает избыточное давление Δp . Если мысленно разрезать сферическую каплю радиуса R на две половинки, то каждая из них должна находиться в равновесии под действием сил поверхностного натяжения, приложенных к границе разреза длиной 2πR и сил избыточного давления, действующих на площадь πR 2 сечения (рис.1.16.1). Условие равновесия записывается в виде
Вблизи границы между жидкостью, твердым телом и газом форма свободной поверхности жидкости зависит от сил взаимодействия молекул жидкости с молекулами твердого тела (взаимодействием с молекулами газа (или пара) можно пренебречь). Если эти силы больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом θ, характерным для данной пары жидкость – твердое тело. Угол θ называется краевым углом . Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то краевой угол θ оказывается тупым (рис.1.16.2(2)). В этом случае говорят, что жидкость не смачивает поверхность твердого тела. В противном случае (угол - острый) жидкость смачивает поверхность (рис.1.16.2(1)). При полномсмачивании θ = 0, при полном несмачивании θ = 180°.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах . Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются.
На рис.1.16.3 изображена капиллярная трубка некоторого радиуса r , опущенная нижним концом в смачивающую жидкость плотности ρ. Верхний конец капилляра открыт. Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю результирующей F н сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: F т = F н, где F т = mg = ρh πr 2 g , F н = σ2πr cos θ.
Отсюда следует: ![]()
При полном смачивании θ = 0, cos θ = 1. В этом случае
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Вода практически полностью смачивает чистую поверхность стекла. Наоборот, ртуть полностью не смачивает стеклянную поверхность. Поэтому уровень ртути в стеклянном капилляре опускается ниже уровня в сосуде.
В этом разделе мы рассмотрим агрегатные состояния , в которых пребывает окружающая нас материя и силы взаимодействия между частицами вещества, свойственные каждому из агрегатных состояний.
1. Состояние твёрдого тела ,
2. Жидкое состояние и
3. Газообразное состояние .
Часто выделяют четвёртое агрегатное состояние – плазму .
Иногда, состояние плазмы считают одним из видов газообразного состояния.
Плазма - частично или полностью ионизированный газ , чаще всего существующий при высоких температурах.
Плазма является самым распространённым состоянием вещества во вселенной, поскоьку материя звёд пребывает именно в этом состоянии.
Для каждого агрегатного состояния характерны особенности в характере взаимодействия между частицами вещества, что влияет на его физические и химические свойства.
Каждое вещество может пребывать в разных агрегатных состояниях. При достаточно низких температурах все вещества находятся в твёрдом состоянии . Но по мере нагрева они становятся жидкостями , затем газами . При дальнейшем нагревании они ионизируются (атомы теряют часть своих электронов) и переходят в состояние плазмы .
Газ
Газообразное состояние (от нидерл. gas, восходит к др.-греч. Χάος ) характеризующееся очень слабыми связями между составляющими его частицами.
Образующие газ молекулы или атомы хаотически движутся и при этом преобладающую часть времени находятся на больших (в сравнении с их размерами) растояниях друг от друга. Вследствие этого силы взаимодействия между частицами газа пренебрежимо малы .

Основной особенностью газа является то, что он заполняет все доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ - изотропное вещество , то есть его свойства не зависят от направления.
При отсутствии сил тяготения давление во всех точках газа одинаково. В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь с высотой. Соответственно, в поле сил тяжести смесь газов становится неоднородной. Тяжелые газы имеют тенденцию оседать ниже, а более легкие - подниматься вверх.
Газ имеет высокую сжимаемость - при увеличении давления возрастает его плотность. При повышении температуры расширяются.
При сжатии газ может перейти в жидкость , но конденсация происходит не при любой температуре, а при температуре, ниже критической температуры. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. Так, например, газ гелий можно ожижить только при температуре, ниже от 4,2 К .
Существуют газы, которые при охлаждении переходят в твердое тело, минуя жидкую фазу. Превращения жидкости в газ называется испарением, а непосредственное превращение твердого тела в газ - сублимацией .
Твёрдое тело
Состояние твёрдого тела в сравнении с другими агрегатными состояниями характеризуется стабильностью формы .
Различают кристаллические и аморфные твёрдые тела .
Кристаллическое состояние вещества
Стабильность формы твёрдых тел связана с тем, что большинство, находящихся в твёрдом состоянии имеет кристалическое строение .
В этом случае расстояния между частицами вещества малы, а силы взаимодействия между ними велики, что и определяет стабильность формы .
В кристаллическом строении многих твёрдых тел легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов и пр.) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствии различного отражения ими света.
В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Формы кристаллов
Каждое вещество образует кристаллы совершенно определённой формы.
Разнообразие кристаллических форм может быть сведено к семи группам:
1. Триклинная (параллелепипед),
2. Моноклинная (призма с параллелограммом в основании),
3. Ромбическая (прямоугольный параллелепипед),
4. Тетрагональная (прямоугольный параллелепипед с квадратом в основании),
5. Тригональная ,
6. Гексагональная
(призма с основанием правильного центрированного
шестиугольника),
7. Кубическая (куб).

Многие вещества, в частности железо, медь, алмаз, хлорид натрия кристализуются в кубической системе . Простейшими формами этой системы являются куб, октаэдр, тетраэдр .
Магний, цинк, лёд, кварц кристализуются в гексагональной системе . Основные формы этой системы – шестигранные призмы и бипирамида .
Природные кристаллы, а также кристаллы, получаемые искусственным путём, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной.
Однако как бы неравномерно не происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла у одного и того же вещества остаются постоянными.
Анизотропия
Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств – прочность, теплопроводность, отношение к свету и др. – не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией .
Внутреннее строение кристаллов. Кристаллические решётки.
Внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, - молекул, атомов или ионов.
Это расположение можно представить в виде кристаллической решётки – пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий – узлах решётки – лежат центры частиц.

В зависимости от природы частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают следующие виды кристаллических решёток :
1. молекулярные ,
2. атомные ,
3. ионные и
4. металлические .
Молекулярные и атомные решётки присущи веществам с ковалентной связью, ионные – ионным соединениям, металические – металам и их сплавам.
В узлах атомных решёток находятся атомы . Они связаны друг с другом ковалентной связью .
Веществ, обладающих атомными решётками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения.
Эти вещества характеризуются высокой твёрдостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства объясняются прочностью ковалентной связи .
В узлах молекулярных решёток находятся молекулы . Они связаны друг с другом межмолекулярными силами .
Веществ с молекулярной решёткой очень много. К ним принадлежат неметаллы , за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические соединения .
Силы межмолекулярного взаимодействия значительно слабее сил ковалентной связи, поэтому молекулярные кристаллы имеют небольшую твёрдость, легкоплавки и летучи.
В узлах ионных решёток располагаются, чередуясь положительно и отрицательно заряженные ионы . Они связаны друг с другом силами электростатического притяжения .
К соединениям с ионной связью, образующим ионные решётки, относится большинство солей и небольшое число оксидов .
По прочности ионные решётки уступают атомным, но превышают молекулярные.
Ионные соединения имеют сравнительно высокие температуры плавления. Летучесть их в большинстве случаев не велика.
В узлах металлических решёток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны .

Наличием свободных электронов в кристаллических решётках металлов можно объяснить их многие свойства: пластичность, ковкость, металлический блеск, высокую электро- и теплопроводность
Существуют вещества, в кристаллах которых значительную роль играют два рода взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентной связью , а в других – металлической . Поэтому решётку графита можно рассматривать и как атомную , и как металлическую .

Во многих неорганических соединениях, например, в BeO, ZnS, CuCl , связь между частицами, находящимися в узлах решётки, является частично ионной , а частично ковалентной . Поэтому решётки подобных соединений можно рассматривать как промежуточные между ионными и атомными .
Аморфное состояние вещества
Свойства аморфных веществ
Среди твёрдых тел встречаются такие, в изломе которых нельзя обнаружить никаких признаков кристаллов. Например, если расколоть кусок обыкновенного стекла, то его излом окажется гладким и, в отличие от изломов кристаллов, ограничен не плоскими, а овальными поверхностями.
Подобная же картина наблюдается при раскалывании кусков смолы, клея и некоторых других веществ. Такое состояние вещества называется аморфным .
Различие между кристаллическими и аморфными телами особенно резко проявляется в их отношении к нагреванию.
В то время как кристаллы каждого вещества плавятся при строго определённой температуре и при той же температуре происходит переход из жидкого состояния в твёрдое, аморфные тела не имеют постоянной температуры плавления . При нагревании аморфное тело постепенно размягчается, начинает растекаться и, наконец, становится совсем жидким. При охлаждении оно также постепенно затвердевает .
В связи с отсутствием определённой температуры плавления аморфные тела обладают другой способностью: многие из них подобно жидкостям текучи , т.е. при длительном действии сравнительно небольших сил они постепенно изменяют свою форму. Например, кусок смолы, положенный на плоскую поверхность, в теплом помещении на несколько недель растекается, принимая форму диска.
Строение аморфных веществ
Различие между кристаллическим и аморфным состоянием вещества состоит в следующем.
Упорядоченное расположение частиц в кристалле , отражаемое элементарной ячейкой, сохраняется на больших участках кристаллов, а в случае хорошо образованных кристаллов – во всём их объёме .
В аморфных телах упорядоченность в расположении частиц наблюдается только на очень малых участках . Кроме того, в ряде аморфных тел даже эта местная упорядоченность носит лишь приблизительный характер.

Это различие можно коротко сформулировать следующим образом:
- структура кристаллов характеризуется дальним порядком ,
- структура аморфных тел – ближним .
Примеры аморфных веществ.
К стабильно-аморфным веществам принадлежат стекла (искусственные и вулканические), естественные и искусственные смолы, клеи, парафин, воск и др.
Переход из аморфного состояния в кристаллическое.
Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состоянии. Диоксид кремния SiO 2 встречается в природе в виде хорошо образованных кристаллов кварца , а также в аморфном состоянии (минерал кремень ).
При этом кристаллическое состояние всегда более устойчиво . Поэтому самопроизвольный переход из кристаллического вещества в аморфное невозможен, а обратное превращение – самопроизвольный переход из аморфного состояния в кристаллическое – возможно и иногда наблюдается.
Примером такого превращения служит расстеклование – самопроизволная кристаллизация стекла при повышенных температурах, сопровождающаяся его разрушением.
Аморфное состояние многих веществ получается при высокой скорости затвердевания (остывания) жидкого расплава.
У металлов и сплавов аморфное состояние формируется, как правило, если расплав охлаждается за время порядка долей-десятков миллисекунд. Для стёкол достаточно намного меньшей скорости охлаждения.
Кварц (SiO 2 ) также имеет низкую скорость кристаллизации. Поэтому отлитые из него изделия получаются аморфными. Однако природный кварц, имевший сотни и тысячи лет для кристаллизации при остывании земной коры или глубинных слоёв вулканов, имеет крупнокристаллическое строение, в отличие от вулканического стекла, застывшего на поверхности и поэтому аморфного.
Жидкости
Жидкость – промежуточное состояние между твёрдым телом и газом.
Жидкое состояние является промежуточным между газообразным и кристаллическим. По одним свойствам жидкости близки к газам , по другим – к твёрдым телам .
С газами жидкости сближает, прежде всего, их изотропность и текучесть . Последняя обуславливает способность жидкости легко изменять свою форму.
Однако высокая плотность и малая сжимаемость жидкостей приближает их к твёрдым телам .
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жёстких сил межмолекулярного взаимодействия.
В то же время низкая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объём, указывает на присутствие хотя и не жёстких, но всё же значительных сил взаимодействия между частицами.
Соотношение потенциальной и кинетической энергии.
Для каждого агрегатного состояния характерно своё соотношение между потенциальной и кинетической энергиями частиц вещества.
У твёрдых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твёрдых телах частицы занимают определённые положения друг относительно друга и лишь колеблются относительно этих положений.
Для газов соотношение энергий обратное , вследствии чего молекулы газов всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объём.
В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы , т.е. частицы связаны друг с другом, но не жёстко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объём.
Стуктуры жидкостей и аморфных тел схожи.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам . В большинстве жидкостей наблюдается ближний порядок – число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всём объёме жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры.
При низких температурах, незначительно превышающих температуру плавления данного вещества, степень упорядоченности расположения частиц данной жидкости велика.
С ростом температуры она падает и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа . При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствии сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твёрдым телам относят только вещества в кристаллическом состоянии.
Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах в отличие от обычных жидкостей частицы имеют незначительную подвижность – такую же как в кристаллах.